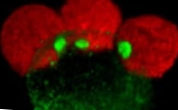
Сряда, 16 януари 2013 г. - Изследователи от Националния център за сърдечно-съдови изследвания (CNIC) са открили две мутации, свързани с тежка наследствена кардиомиопатия, неуплътнена кардиомиопатия на лявата камера (LVNC). Откритието им с важни клинични последици е публикувано в списанието „Nature Medicine“. По-конкретно, авторите на доклада, водени от координатора на Програмата за биологично развитие на сърдечно-съдовото развитие Жозе Луис де ла Помпа, показаха, че мутациите в гена MIB1 са отговорни за наследствената LVNC, тежка патология, която засяга много семейства по целия свят
Това е заболяване, което се проявява в влошаване на вентрикуларната контрактилна функция поради наличието в зряла възраст на трабекули, гребени на сърдечния мускул, покрити от сърдечен ендотел, които, както обясняват авторите, растат навътре на вентрикулите по време на развитието и образуват сложна мрежа, подобна на структурата на гъбата.
Субектите с тази патология могат да страдат от тежка сърдечна недостатъчност, която се нуждае от много близко управление и в най-тежките случаи сърдечната трансплантация е единствената терапевтична възможност. В допълнение, дори пациентите със сравнително нормална контрактилна функция имат висок риск да имат тежки аритмии - причиняващи внезапна смърт - и дори церебрални емболии.
"Въпреки че се подозираше, че произходът на този камерен дефект е в развитието на плода, за първи път той демонстрира осезаемо в експериментален модел", казва Де ла Помпа, който поясни, че други гени, свързани с болестта, способна да кодира структурни протеини на сърдечния мускул.
"Това е първият път, когато мутациите са идентифицирани в ген, който кодира протеин, необходим за правилното активиране на сигналния път, по-специално пътя на NOTCH", подчерта той.
По същия начин тази констатация има големи клинични последици, тъй като може да бъде включена в батерията на генетичния анализ при пациенти с некомплектна кардиомиопатия и дори при пациенти с несигурни камерни нарушения. Изследователската група обаче продължава тази линия на работа и проучва прогнозата на пациенти с LVNC, вторични за тази мутация във връзка с други мутации.
"Проблемът е, че няма лечение за това заболяване, освен от спокоен начин на живот, имплантирането на автоматични дефибрилатори за лечение на злокачествени аритмии и понякога прилагането на антикоагуланти за предотвратяване на церебрални емболии, придружени от мониторинг от специалисти “, добави експертът на CNIC.
Тази работа, ръководена от De la Pompa, е резултат от "много тясно" мултидисциплинарно сътрудничество, което имаше много активно участие на кардиолози, специализирани в кардиомиопатии от различни болници в Испания (Мурсия, Коруня, Мадрид). Изследователската група постигна това начин да се събере една от най-широките серии от пациенти с тази патология в света.
"Следващата ни стъпка е да разработим индуцирани плюрипотентни клетки на тези пациенти, за да проучим способността им да се диференцират в кардиомиоцити. Надяваме се да получим повече информация от този експеримент", установява де ла Помпа.
Източник:
Тагове:
Диета-И-Хранене хранене Секс
Това е заболяване, което се проявява в влошаване на вентрикуларната контрактилна функция поради наличието в зряла възраст на трабекули, гребени на сърдечния мускул, покрити от сърдечен ендотел, които, както обясняват авторите, растат навътре на вентрикулите по време на развитието и образуват сложна мрежа, подобна на структурата на гъбата.
Субектите с тази патология могат да страдат от тежка сърдечна недостатъчност, която се нуждае от много близко управление и в най-тежките случаи сърдечната трансплантация е единствената терапевтична възможност. В допълнение, дори пациентите със сравнително нормална контрактилна функция имат висок риск да имат тежки аритмии - причиняващи внезапна смърт - и дори церебрални емболии.
"Въпреки че се подозираше, че произходът на този камерен дефект е в развитието на плода, за първи път той демонстрира осезаемо в експериментален модел", казва Де ла Помпа, който поясни, че други гени, свързани с болестта, способна да кодира структурни протеини на сърдечния мускул.
"Това е първият път, когато мутациите са идентифицирани в ген, който кодира протеин, необходим за правилното активиране на сигналния път, по-специално пътя на NOTCH", подчерта той.
По същия начин тази констатация има големи клинични последици, тъй като може да бъде включена в батерията на генетичния анализ при пациенти с некомплектна кардиомиопатия и дори при пациенти с несигурни камерни нарушения. Изследователската група обаче продължава тази линия на работа и проучва прогнозата на пациенти с LVNC, вторични за тази мутация във връзка с други мутации.
"Проблемът е, че няма лечение за това заболяване, освен от спокоен начин на живот, имплантирането на автоматични дефибрилатори за лечение на злокачествени аритмии и понякога прилагането на антикоагуланти за предотвратяване на церебрални емболии, придружени от мониторинг от специалисти “, добави експертът на CNIC.
Тази работа, ръководена от De la Pompa, е резултат от "много тясно" мултидисциплинарно сътрудничество, което имаше много активно участие на кардиолози, специализирани в кардиомиопатии от различни болници в Испания (Мурсия, Коруня, Мадрид). Изследователската група постигна това начин да се събере една от най-широките серии от пациенти с тази патология в света.
"Следващата ни стъпка е да разработим индуцирани плюрипотентни клетки на тези пациенти, за да проучим способността им да се диференцират в кардиомиоцити. Надяваме се да получим повече информация от този експеримент", установява де ла Помпа.
Източник:










.jpg)